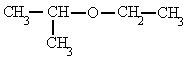- Un éter es un grupo funcional del tipo R-O-R', en donde R y R' son grupos alquino, iguales o distintos, estando el átomo de oxigeno unido a éstos.
 |
| "FÓRMULA " |
- Se puede obtener un éter de la reacción de condensación entre dos alcoholes (aunque no se suele producir directamente y se emplean pasos intermedios)
- La mayoría de los éteres son líquidos volátiles, ligeros e inflamables, solubles en alcoholes y otros disolventes orgánicos. Desde el punto de vista químico, son compuestos inertes y estables; los álcalis o los ácidos no los atacan fácilmente.
- Están estrechamente relacionados con los alcoholes, y se obtienen directamente de ellos. El compuesto más típico y más utilizado de este grupo es el éter común o etílico, normalmente denominado éter.
- Se les puede considerar el resultado de sustituir el hidrógeno del grupo OH de los alcoholes por un radical hidrocarbonado. Según el tipo de estos radicales, los éteres pueden ser:
- Alifáticos : R—O—R (los dos radicales alquílicos).
- Aromáticos: Ar—O—Ar (los dos radicales arílicos).
- Mixtos: R—O—Ar (un radical alquílico y otro arílico).
Historia:
 Se atribuye su descubrimiento al alquimista Ramon Llull en el año 1275,
aunque no hay evidencia contemporánea que lo afirme. Fue sintetizado por
primera vez en 1540 por Valerius Cordusque lo llamó aceite dulce de vitreolo
(oleum dulci vitrioli). El nombre se debe a que fue descubierto de la
destilación de etanol y ácido sulfúrico (conocido antiguamente como aceite de
vitreolo,porque se producía a partir de ese mineral), y descubrió algunas de
sus propiedades medicinales. Aproximadamente al mismo tiempo, Theophrastus
Bombastus von Hohenheim (mejor conocido como Paracelsus)descubrió sus
propiedades analgésicas. El nombre éter fue dado a la substancia en 1730 por A.
S. Frobenius.
Se atribuye su descubrimiento al alquimista Ramon Llull en el año 1275,
aunque no hay evidencia contemporánea que lo afirme. Fue sintetizado por
primera vez en 1540 por Valerius Cordusque lo llamó aceite dulce de vitreolo
(oleum dulci vitrioli). El nombre se debe a que fue descubierto de la
destilación de etanol y ácido sulfúrico (conocido antiguamente como aceite de
vitreolo,porque se producía a partir de ese mineral), y descubrió algunas de
sus propiedades medicinales. Aproximadamente al mismo tiempo, Theophrastus
Bombastus von Hohenheim (mejor conocido como Paracelsus)descubrió sus
propiedades analgésicas. El nombre éter fue dado a la substancia en 1730 por A.
S. Frobenius.Uso anestésico:
El doctor norteamericano M. D. Crawford Williamson Long fue el primercirujano que lo empleó como anestésico general el 30 de marzo de 1842. El éter no se usa mientras haya otro anestésico disponible, por su inflamabilidad y porque es irritante para algunos pacientes.Debido a esas razones, junto con su alta inflamabilidad y su bajo punto de ignición, el éter etílico es considerado como uno de los factores de riesgo de los laboratorios.
El éter puede usarse para anestesiar garrapatas antes de eliminarlas de un cuerpo animal o humano. La anestesia relaja a la garrapata y evita que mantenga su boca debajo de la piel.
Los efectos anestésicos del éter le han hecho una droga recreacional, aunque no popular. El éter etílico no es tan tóxico como otros solventes utilizados como drogas recreacionales
El éter fue vendido a finales de 1800 como 'medicinal' para las mujeres. No era considerado apropiado que las mujeres beban alcohol, especialmente durante el movimiento del temperance, así que en su lugar se tomaron las medicinas extremadamente potentes cuando los hombres las hacían beber.
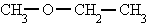
metoxietano
- También podemos nombrar los dos radicales, por orden alfabético, seguidos de la palabra "éter".
etil isopropil éter
Propiedades químicas:
 Los éteres tienen muy poca reactividad química, debido a la dificultad que presenta la ruptura del enlace C—O. Por ello, se utilizan mucho como disolventes inertes en reacciones orgánicas. En contacto con el aire sufren una lenta oxidación en la que se forman peróxidos muy inestables y poco volátiles. Estos constituyen un peligro cuando se destila un éter, pues se concentran en el residuo y pueden dar lugar a explosiones. Esto se evita guardando el éter con hilo de sodio o añadiendo una pequeña cantidad de un reductor (SO4Fe, LiAIH4) antes de la destilación .
Los éteres tienen muy poca reactividad química, debido a la dificultad que presenta la ruptura del enlace C—O. Por ello, se utilizan mucho como disolventes inertes en reacciones orgánicas. En contacto con el aire sufren una lenta oxidación en la que se forman peróxidos muy inestables y poco volátiles. Estos constituyen un peligro cuando se destila un éter, pues se concentran en el residuo y pueden dar lugar a explosiones. Esto se evita guardando el éter con hilo de sodio o añadiendo una pequeña cantidad de un reductor (SO4Fe, LiAIH4) antes de la destilación .Propiedades físicas:
El éter metílico (P.e. -24°C) y el éter metil etílico (P.e. 8°C) son gases a temperatura normal. Ya el éter etílico (P.e. 35°C) es un líquido muy volátil. Los éteres con cadenas carbonadas mayores van teniendo mayor punto de ebullición a medida que aumenta la longitud de la cadena.Los éteres de cadena recta tiene un punto de ebullición bastante similar a los alcanos con peso molecular comparable. Por ejemplo: el éter C2-H5-O-C2-H5, con peso molecular 74 tiene un punto de ebullición de 35°C, y el alcano CH3-CH2-CH2-CH2-CH3 de peso molecular 72 tiene un punto de ebullición de 36°C.
Los éteres tienen una solubilidad en agua comparable con los alcoholes para peso molecular similar, así el éter C2-H5-O-C2-H5 tiene la misma solubilidad que el alcohol CH3-CH2-CH2-CH2-OH unos 8g/100ml de agua a 25°C.
- Los éteres de forma compleja son muy abundantes en la vida vegetal formando parte de las resinas de las plantas, colorantes de flores y otros.
- El éter etílico (o simplemente éter), se obtiene estéticamente, y es un depresor del sistema nervioso central, por este motivo ha sido utilizado como anestésico.
- Probablemente el éter sea la sustancia mas utilizada en el laboratorio para los procesos de extracción con solvente, aun siendo potencialmente peligroso por su inflamabilidad y volatilidad.
- Medio para extractar para concentrar ácido acético y otros ácidos
- Medio de arrastre para la deshidratación de alcoholes etílicos e isopropílicos.
- Disolvente de sustancias orgánicas (aceites, grasas, resinas, nitrocelulosa, perfumes y alcaloides).
- Combustible inicial de motores Diésel.
- Es llamado la medicina antigua porque en la antigüedad se usaba como anestésico, debido a que no existían los métodos de anestesia moderna.
Nomenclatura de los éteres:
Para nombrar los éteres tenemos dos alternativas:
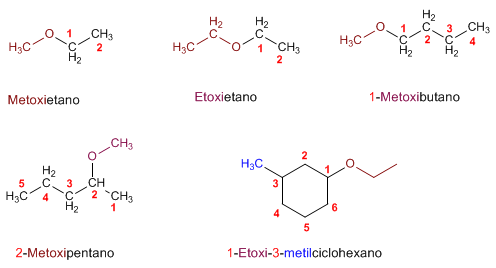
- Primera: Considerar el grupo alcoxi como un sustituyente (siendo R el radical más sencillo).
- Segunda: Citar los dos radicales que están unidos al O por orden alfabético y a continuación la palabra éter.

Tipos de éteres:
 Éteres corona: Hay éteres que contienen más de un grupo funcional éter (poliéteres) y algunos de éstos forman ciclos; estos poliéteres se denominan éteres corona. Pueden sintetizarse de distintos tamaños y se suelen emplear como ligandos, para acomplejar selectivamente (por el tamaño) a cationes alcalinos. Los oxígenos establecen interacciones con el catión, que se coloca en el centro del ciclo, formándose un complejo. Existen en la naturaleza compuestos de este tipo.
Éteres corona: Hay éteres que contienen más de un grupo funcional éter (poliéteres) y algunos de éstos forman ciclos; estos poliéteres se denominan éteres corona. Pueden sintetizarse de distintos tamaños y se suelen emplear como ligandos, para acomplejar selectivamente (por el tamaño) a cationes alcalinos. Los oxígenos establecen interacciones con el catión, que se coloca en el centro del ciclo, formándose un complejo. Existen en la naturaleza compuestos de este tipo.
Poliéteres: Se pueden formar polímeros que contengan el grupo funcional éter. Un ejemplo de formación de estos polímeros: R-OH + n(CH2)O ! R-O-CH2-CH2-O-CH2-CH2-O-CH2-CH2-O-.. Los poliéteres más conocidos son las resinas epoxi, que se emplean principalmente como adhesivos. Se preparan a partir de un epóxido y de un dialcohol.
 Epóxidos u oxiranos: Los epóxidos u oxiranos son éteres en donde el átomo de oxígeno es uno de los átomos de un ciclo de tres. Son pues compuestos heterocíclicos. Los ciclos de tres están muy tensionados, por lo que reaccionan fácilmente en reacciones de apertura, tanto con bases como con ácidos.
Epóxidos u oxiranos: Los epóxidos u oxiranos son éteres en donde el átomo de oxígeno es uno de los átomos de un ciclo de tres. Son pues compuestos heterocíclicos. Los ciclos de tres están muy tensionados, por lo que reaccionan fácilmente en reacciones de apertura, tanto con bases como con ácidos.
Éteres de silicio: Hay otros compuestos en los que el grupo funcional no es R-O-R', estando el oxígeno unido a dos carbonos, pero siguen siendo llamados éteres. Por ejemplo, los éteres de silicio, en donde la fórmula general es R-O-Si, es decir, el oxígeno está unido a un carbono y a un átomo de silicio. Sigue habiendo un par de electrones no enlazantes. Estos compuestos se llaman éteres de silicio.
Punto de vista:
- Lo éteres son un gran aporte para la medicina antigua ya que era utilizada como anestésico al producir la inconsciencia mediante la depresión del sistema nervioso central
- Una de las características mas importante de los éteres es que es uno de los mejores disolventes de sustancias orgánicas como:
Aceites
Resinas
Nitrocelulosa
Perfumes
Alcaloides
- Los fabricantes de productos químicos lo utilizan para sintetizar y analizar los productos .Generalmente los químicos suelen usar lo éteres isopropílicos como disolvente en cromatografía (un proceso en el cual una mezcla química por un líquido o gas se separa en componentes como resultado de la distribución diferencial de los solutos mientras fluyen alrededor o a través de una fase estacionaria líquida o sólida)
Vídeos relacionados:
Experimento
.gif)